ARTÍCULO ORIGINAL
Variante de cálculo de infusión de ketamina en la TIVA manual
A Variant for calculating ketamine infusion in manual total intravenous anesthesia
Víctor Navarrete Zuazo, Damaris Flores Vargas, Reinier Meneses Rodríguez
Clínica Central "Cira García". La Habana, Cuba.
RESUMEN
Introducción:
Un requisito en la conducción de la anestesia intravenosa total, en modo
manual, radica en la necesidad de realizar ajustes de dosificación temporales
para evitar la acumulación plasmática del fármaco. Desde hace
algunos años existe el interés de emplear otros fármacos como
la ketamina.
Objetivos:
Comparar la variación temporal de la concentración plasmática
de ketamina al aplicar una variante de cálculo de decrecimiento de la velocidad
de infusión (Vinf) con una velocidad de infusión invariable.
Métodos:
Se realizó un estudio analítico que describe el cálculo de dosificación
para TIVA manual, la simulación farmacocinética del comportamiento
de la concentración plasmática de la ketamina en caso de administrarse
invariablemente con esos regímenes de dosificación, en un paciente
virtual, de 70 Kg, según el modelo de Domino y el análisis de la variante
de cálculo de decrecimiento de la Vinf del medicamento. Se estimó
una significación estadística de un 95 % (p<0.05).
Resultados:
la variante de cálculo de decrecimientode la velocidad de infusión:
Vinf (tn) = Vinf (tn-1) _ [(Vinf
(tn-1) x e(1 + 1/t)t)/100] =
Vinf (t n-1) x 0,85 permitió valores más
estables de la concentración plasmática, aproximadas a la del modelo
ideal (p>0,05), por espacio de 6 h.
Conclusiones:
es probable que el decrecimiento de la dosis de ketamina, establecido por la
variante de cálculo e infusión propuesta, posibilite una mejor estabilidad
de la concentración plasmática.
Palabras clave: TIVA manual; infusión intravenosa; farmacocinética; monocompartimental; ketamina; simulación.
ABSTRACT
Introduction:
A requirement in the manual conduction of total intravenous anesthesia is the
need to make temporary dosage adjustments to avoid drug accumulation in plasma.
For some years there has been interest in using other drugs such as ketamine.
Objectives: To compare the temporal variation of ketamine concentration
in plasma when applying a variant for calculating the decrease in the infusion
rate (Vinf) with an invariable infusion rate.
Methods: An analytical study was carried out describing the dosage calculation
for manual total intravenous anesthesia, the pharmacokinetic simulation of the
behavior of ketamine concentration in plasma in case of being invariably administered
with these dosing regimens, in a virtual patient, of 70 kg, according to the
Domino model and the analysis of the variant for calculating the decrease of
ketamine infusion rate. A statistical significance of 95% was estimated (p<0.05).
Results: The variant for calculating the decrease of the infusion rate:
Vinf (tn) = Vinf (tn-1) _ [(Vinf (tn-1) x e (1+1/t) t)/100] = Vinf (tn -1) x
0.85 allowed more stable values of plasma concentration, which approximate that
of the ideal model (p>0.05), for a time of 6 hours.
Conclusions: Probably, the decrease of the ketamine dose, established
by the proposed calculation and infusion variant, allows better stability of
plasma concentration.
Keywords:
manual total intravenous anesthesia; intravenous infusion; pharmacokinetics;
monocompartimental.
INTRODUCCIÓN
La administración de fármacos se ha tornado un tema de sumo interés para la medicina hace ya varios años.1,2 La anestesiología no escapa de esto, más cuando se trata de la anestesia intravenosa total (TIVA, por sus siglas en inglés), modalidad para la cual se han desarrollado múltiples herramientas de cálculo basadas en modelos farmacocinéticos.3,4
El objetivo de esta modalidad de la anestesiología es la predictibilidad farmacológica, es decir, realizar cálculos de dosificación lo suficientemente precisos como para predecir la concentración de un fármaco en sangre y/o en el sitio efector o biofase y su efecto a tales valores. Dichos cálculos son complejos, por lo tanto son generalmente realizados por programas informáticos.5-7
A pesar del inmenso avance de los modelos más usados en farmacocinética, como son los "compartimentales mamilares", no deja de reconocerse las fallas o limitaciones de estos.8-10 Al ocurrir esto, es elemental esperar sesgos en el cálculo de dosificación y predicción de la concentración plasmática de las drogas, pero siempre en menor cuantía que cuando se utiliza la TIVA manual; es decir, aquella que es realizada por los cálculos de dosificación que aplica el anestesiólogo, donde los regímenes de infusión de fármacos es dirigido directamente por el personal profesional a través de diferentes técnicas o dispositivos.4,11
Resulta elemental esperar mayores sesgos en el cálculo de dosificación y predicción de la concentración plasmática cuando se emplea la modalidad de TIVA manual, pero esta es frecuentemente utilizada debido a las limitaciones tecnológicas, ya que en muchas regiones los anestesiólogos no poseen los recursos pertinentes que le faciliten la posibilidad de realizar la anestesia intravenosa con infusión controlada a la diana o sitio efector (TIVA/TCI), o modalidades de conducción de la concentración plasmática (Cp) dirigidos por programas informáticos como Rugloop y Anestfusor, reconocidos a nivel internacional, los cuales contienen metodologías de cálculos de modelos farmacocinéticos policompartimentales con posibilidad de ser empleados, tanto en modo simulación como en tiempo real para el uso terapéutico en pacientes un ejemplo de ello es el modelo de Domino para ketamina.10,12,13
No obstante, con la TIVA manual se pueden alcanzar muy buenos resultados, sobre todo si se realizan cálculos concienzudos y una adecuada monitorización del paciente.
Para la administración de fármacos en la TIVA manual se prefiere el empleo de bombas de infusión convencionales como las volumétricas y las jeringuillas perfusoras, ambas con un bajo índice de error.
A pesar que los modelos mamilares o policompartimentales (bicompartimentales o tricompartimentales) son los más próximos a la realidad, la complicación que conlleva (los cálculos de dosificación en el tiempo para mantener una concentración plasmática) ha hecho que sea el modelo monocompartimental y en todo caso el bicompartimental, en múltiples situaciones, los más usados. Precisamente, los cálculos de dosificación para TIVA manual se refieren a las fórmulas de la cinética lineal del modelo monocompartimental, útil para fármacos que se distribuyen con rapidez desde el plasma a otros fluidos y tejidos.14,15 Pero el principal dilema en la conducción de la TIVA manual radica en la necesidad de realizar ajustes de dosificación temporales para evitar la acumulación plasmática del fármaco y sus metabolitos en el paciente, después de la administración de un bolo y la continuidad de la administración mediante una infusión continua, sobre todo de medicamentos capaces de producir este fenómeno.16
De no tenerse en cuenta lo anterior, se incurre en un error terapéutico que puede producir situaciones como la afectación de: la predicción del tiempo de despertar, la recuperación de los reflejos de la vía respiratoria del paciente, alteraciones hemodinámicas, entre otros, según el o los fármacos empleados durante el acto anestésico.
Desde hace algunos años la ketamina ha captado cada vez más interés como componente analgésico de la TIVA por su versatilidad. En los años 50, las industrias Parke-Davis buscaban, entre las drogas derivadas de la ciclohexamina, un agente anestésico ideal con propiedades analgésicas.12
La primera droga sintetizada fue la phenciclidine (PCP) pero su uso abusivo como droga recreacional detuvo su producción en 1978. Debido a los efectos sicodislépticos de la ciclohexamina, investigaciones ulteriores llevaron finalmente en los años de la década del 60 a la síntesis y desarrollo de la ketamina.13
Por ello, este artículo intenta analizar cómo se realiza habitualmente el cálculo de TIVA manual y cómo se comporta la concentración plasmática de medicamentos como la ketamina, en caso de no realizarse el decrecimiento de la dosificación en el tiempo, es decir, una infusión a ritmo fijo. Además, se expone una propuesta de cómo realizar el cálculo del decrecimiento temporal de la dosificación de este medicamento.
Así, el objetivo de la investigación es comparar la variación temporal de la concentración plasmática de ketamina tras una velocidad de infusión invariable y al aplicar una variante de cálculo de decrecimiento de la velocidad de infusión (Vinf).
MÉTODOS
Se realizó un estudio analítico, el cual se dividió en dos etapas:
Etapa 1
A. Un análisis matemático describe cómo se realiza, en la práctica clínica, el cálculo del bolo y de la velocidad de infusión de una droga para TIVA manual (modelo fármacocinético monocompartimental).
B. Con los resultados anteriores de dosificación invariable de la V inf (tn) se procedió a la realización de cinco simulaciones farmacocinéticas (N=5) con el modelo de Domino (ajustado al peso, modo bolo infusión), para los cálculos de Cp de ketamina del programa Anestfusor.
Etapa 2
C. Análisis de dos variantes de decrecimiento temporal del medicamento, que requirió un análisis matemático y generó las fórmulas de cálculo variación de la dosificación en el tiempo.
D. Con los resultados anteriores, de la dosificación en el tiempo, se procedió a la realización de cinco simulaciones farmacocinéticas (N=5) con el modelo de Domino (ajustado al peso, modo bolo infusión), para los cálculos de Cp de ketamina del programa Anestfusor.
Se empleó la modalidad bolo-perfusión, por ser la utilizada generalmente en TIVA manual.
Los cálculos de las simulaciones se realizaron con el valor del peso ideal de un paciente virtual:
· Paciente masculino (no influye en los cálculos del modelo de Domino)
· Talla=170 cm (no influye en los cálculos del modelo de Domino)
Se tuvo en cuenta que los resultados de los cálculos de Cp y su mantenimiento en el tiempo mediante la determinación de la V inf (tn), con las fórmulas concebidas para TIVA manual, podrían ser diferentes a los resultados de los cálculos realizados por el programa informático según los parámetros de modelación farmacocinética de Domino. No es objetivo de este estudio hacer un análisis de estas diferencias.
Se tomó como criterio que un modelo ideal fuera el modelo de cálculos farmacocinéticos que proporcionara valores de Cp (t) invariables. Para realizar la comparación de los valores de Cp(t) de las simulaciones efectuadas se construyó un modelo ideal de comportamiento de la Cp(t), siendo el valor inicial el promedio de los valores de Cp de los picos plasmáticos, y el resto de los valores de la Cp(t) el promedio de valor determinado a los 15, 30, 50, 90 min; 2 y 50 min; 5 h y 45 min en las simulaciones farmacocinéticas.
Los cálculos, tablas y gráficos fueron realizados a través de una herramienta de cálculo confeccionada en un libro del programa Microsoft Office Excel 2013 con el complemento XLSTAT.
Para establecer las diferencias estadísticas entre los resultados fue empleado la prueba t de Student. Se estimó una significación estadística de un 95 % (p<0,05).
Consideraciones éticas
Este estudio se realizó totalmente en modo simulación y no directamente sobre pacientes, en tiempo real, no obstante las dosis de los fármacos con las cuales se trabajó son seguras, es decir, están establecidas dentro del rango terapéutico permisivo reportado por las autoridades sanitarias.
RESULTADOS
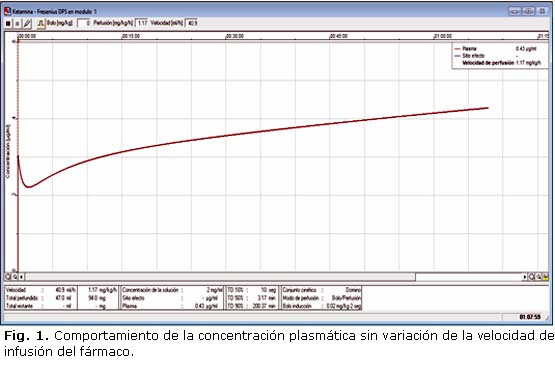
La determinación del intervalo de tiempo en estas observaciones se realizó en períodos de tiempo variable según lo señalado por la curva de la Cp mostrada en el simulador (fig. 1) y se tuvo en cuenta que a los 14 min es el tiempo promedio cuando comienza el incremento de la Cp de ketamina, al realizar las simulaciones con Vinf(t) para mantenimiento constante, sin decrecimiento (~2ee = 2x7.2~15).
La determinación del intervalo de tiempo para la variación de la velocidad de infusión de ketamina constituye un elemento importante para la práctica clínica sobre todo cuando se realiza directamente por el operador la reprogramación de la Vinf en los equipos de perfusión, lo cual debe ser un método cómodo y sencillo para el anestesiólogo. Por esta razón, se decidió realizar las variaciones de la Vinf (t n) a partir de los 15 min y establecer el resto de los momentos de variación de la Vinf de acuerdo al momento en que la curva de simulación alcanzó la concentración plasmática deseada, siguiendo el análisis anteriormente comentado, que en el caso de la ketamina fueron 15, 30, 50, 90 min, 2 y 50 min; 5 h y 45 min.
Simulación 1
Ketamina (S1-K)
Características farmacocinéticas Modelo TIVA manual: Rango terapéutico de Cp (µg/mL)=0,05-0,3; Vdt peak (mL/kg)=63; CL (mL/kg/min)=64,9.
Concentración de la disolución de ketamina=2 mg/mL.
Cálculos para Cp=0,3mcg/mL: Dosis bolo=2 mg (0,02 mg/kg); V inf=1,17 mg/kg/h (48,1 mL/h).
Hay que tener en cuenta que las diferencias entre la Cp deseada (Cp=0,3 µg/mL) para la cual se realizaron los cálculos de dosificación del medicamento y las observadas según los cálculos realizados por el modelo de Domino, difieren sustancialmente. La explicación a este hecho puede ser, no solo que se haya empleado para la observación un modelo tricompartimental, sino también que el Vd que aporta la literatura para los cálculos de dosificación de ketamina en modelo monocompartimental, no se encuentra ajustado al llamado "volumen de distribución para el efecto pico", y se subestima además el CL.
Se tomó como un modelo ideal el de cálculos farmacocinéticos que proporciona valores de Cp(t) invariables. Los resultados de S1-K con respecto a este modelo se presentan en la figura 2.
Se analizó una variante de cálculo de decrecimiento (Vinf (tn) = Vinf (tn-1) x 0.85) y se obtuvieron a través de ella los siguientes valores de Cp(t). (Fig. 2)
Simulación 2
Ketamina (S2-K)
Los datos fueron los empleados en S1-K cuando se aplicó la variación de la velocidad de infusión inicial (1,17 mg/kg/h) según la fórmula:
Vinf (tn)=Vinf (tn-1) _ [(Vinf (tn-1)x e(1 + 1/t)t)/100]=Vinf (tn-1) x 0,85
La figura 2 muestra que las diferencias de la Cp al aplicar la variante de decrecimiento resultaron no significativas con respecto al modelo ideal.
La descripción de los modelos farmacocinéticos (monocompartimentales o policompartimentales) es un aspecto básico para la comprensión de cómo se debe administrar cualquier medicamento en la práctica clínica anestesiológica; sin embargo, la teoría suele ser tan interesante como compleja, sobre todo por las expresiones matemáticas con las que se describe, por lo que queda en el plano de lo abstracto o lo poco comprensible para muchos.17 Es por esto que este estudio se centra en una descripción comprensible de las particularidades del modelo monocompartimental, que es el que se tiene en cuenta para los cálculos de la TIVA manual.
El modelo farmacocinético monocompartimental representa al organismo como un cubo o un tanque de distribución homogénea y a diferencia de los mamilares o policompartimentales utilizados por los modelos de cálculo de medicamentos, presupone que las concentraciones plasmáticas de un fármaco son fiel reflejo de las concentraciones en otros fluidos o tejidos, y que la eliminación del fármaco es directamente proporcional a los niveles de dicho fármaco en el organismo (cinética de primer orden); graficándolo como un tanque se puede decir que la velocidad a la que drena el agua que se encuentra en su interior y es proporcional a la cantidad de agua que contiene.
Sin embargo, no siempre estos presupuestos recogen con una fidelidad aproximada lo que ocurre realmente en el organismo. Por ejemplo, no todos los tejidos presentan igual riqueza en aporte sanguíneo, por lo que en unos la distribución del fármaco será más lenta que en otros.
La concepción para el cálculo de la dosificación de un fármaco al tener en cuenta este modelo es el siguiente:
Si se conoce la concentración que se quiere conseguir (para el paciente sería la concentración plasmática o Cp), y el volumen del tanque (volumen de distribución para el paciente o Vd), al reordenar la definición de concentración se obtiene la dosis o cantidad de fármaco a administrar (D) para alcanzar la Cp según la fórmula D = Cp x Vd.
Para este modelo, además, se supone que el líquido se expulsa fuera del cubo o tanque con una velocidad constante, proceso denominado aclaramiento (CL). Si se supone que el flujo de salida del tanque es constante (CL), su volumen (Vd) no lo es porque disminuye conforme sale el líquido por el desagüe. Sin embargo, puede abrirse una tubería que añada líquido al tanque con una velocidad equiparable al aclaramiento para mantener el volumen constante. En el caso de un paciente, el cálculo de la velocidad de infusión tiene en cuenta esto, y se concibe que la cantidad de fármaco a administrar en el tiempo deba ser igual a su salida en igual magnitud de tiempo. Es por eso que el cálculo se realiza de la siguiente forma: Vinf =Cp x CL.
Sin embargo, mantener esta velocidad fija en el tiempo es una decisión errónea ya que la Cp crece en el tiempo por acumulación del fármaco (en este caso la ketamina) ya que la velocidad de entrada al organismo excede la velocidad de metabolismo y eliminación (CL).
Este fenómeno quedó reflejado en la simulación 1 de ketamina (S1-K) y en la figura 1 (arriba izquierda).
Sin embargo, los modelos policompartimentales establecen la variación del ritmo de infusión en el tiempo, para mantener niveles plasmáticos estables de un fármaco por la fórmula exponencialmente decreciente.[14,15,18] Para el caso del modelo tricompartimental de Domino se emplea la fórmula D(t) = Cpx V1( k10 + k12e -k21t+ k13e-k31t), lo cual permite crear un modelo de simulación ideal para el análisis de la estabilidad de la Cp, empleándose también para la administración de fármacos en tiempo real (TCI). Así se logra que la Cp se mantenga prácticamente constante en el tiempo con dicho régimen de infusión. Teniendo en cuenta esto se construyó el modelo ideal de comparación.
A partir de esto es necesario que, al igual que para los modelos policompartimentales, se establezca un ritmo de decrecimiento para la TIVA manual con ketamina que evite el fenómeno de acumulación plasmática, anteriormente reflejado en la simulación S1- K (Fig. 2).
Es así que el análisis partió de la siguiente interrogante:
¿Cuánto debe disminuir la velocidad de infusión con respecto al cálculo inicial? Para dar respuesta a este problema se analizó en ¿qué tanto por ciento (%) se debería disminuir progresivamente la dosis?; de esta manera se estableció una relación entre la dosis en curso (Da) y la precedente (D b), por lo tanto (Db = Da- Da %).
Para determinar el porciento de decrecimiento de la dosis Da (D a %) se tuvo en cuenta lo que se denomina "la función de decrecimiento exponencial, M(t) = M0e-(t/r) ", la cual es en la práctica la ecuación de decrecimiento más utilizada, siendo M el valor de la magnitud (Vinf = Db) a perfundir y M0 (Da) el valor inicial de la magnitud cuyo decrecimiento exponencial se está estudiando en la unidad de tiempo t, y r la constante de ritmo temporal de decrecimiento. (Fig. 3).
De esta el análisis se centró en el comportamiento exponencial del decrecimiento y así en la función o expresión exponencial y = f(x) = ex (e es el número de Euler) para su inclusión en el ajuste del % de decrecimiento. La función exponencial ex es utilizada para modelar una relación en la cual un cambio constante de la variable independiente (x) proporciona el mismo cambio proporcional (Ej. porcentaje de crecimiento o decrecimiento) en la variable dependiente. La función exponencial es utilizada en física, química, matemáticas, procesos biológicos.15,16 Además, el número de Euler (e=2,72) trasciende a la descripción del comportamiento de acontecimientos físicos regidos por leyes sencillas, entre los que se incluye la velocidad de vaciado de un depósito de agua, lo cual guarda relación con la teoría del modelo monocompartimental.
El exponente X se asumió como el límite de la sucesión f(x) =(1 + 1/n)n, por lo que x=e, entonces e e.
Al tenerse en cuenta lo anteriormente expuesto se propuso la hipótesis siguiente.
Hipótesis de cálculo de ajuste de Vinf (t): Se analizó una variante de cálculo de decrecimiento, y se incluyó el factor tiempo (t) a la expresión matemática, y se asumió que para el exponente e, representado por la expresión f(x) = (1 + 1/n)n, n=t; t pertenece a los números naturales.
Por lo tanto:
Vinf (tn) = Vinf (tn-1) _ [(Vinf (tn-1)x e (1 + 1/t)t)/100], para t > 0.
Vinf (tn) representa la velocidad a la que se debe infundir en el intervalo de tiempo en curso (tn), y V inf (tn-1) es la velocidad de infusión que se aplicó en tn-1, el intervalo de tiempo transcurrido hasta t n(t1, t2, t3, t4 ….t(n-1), tn).
t=tiempo en minutos (min), siendo: t1=15 min; t2=30 min; t3=50 min; t4=90 min; t5=170 min; t 6=345 min.
Esta fórmula para la clínica práctica puede simplificarse a:
Vinf (tn) = Vinf (tn-1) x 0,85
La variante de cálculo de decrecimiento permitió observaciones en las simulaciones realizadas de valores más estables de la Cp durante las primeras 6 h, aproximadas a la del modelo ideal, tendencia que se pretende conseguir en la práctica (Fig. 2).
La probabilidad que este comportamiento se cumpla queda reforzada por la prueba t de Student al no ser la diferencia de S1-K con respecto al modelo ideal estadísticamente significativa (p=0,02). La diferencia de S2-K con respecto al modelo ideal, durante el período de tiempo representado gráficamente no es significativa estadísticamente (p< 0,0001).
Con respecto a la simulación S2-K, nótese que a partir de las 5 h y 55 min se mantuvo una velocidad de infusión de 0,44 mg/kg/h, ya que la tendencia del comportamiento de la Cp es el decrecimiento progresivo, y en caso de prolongarse la infusión a 6 h con esta velocidad, el decrecimiento se sostiene y se puede caracterizar mediante la curva de tendencia que responde a la función f(x)=0.3*e- 0,0067 y es, en ese momento, la Cp calculada por el modelo farmacocinético de 0,29 mcg/mL; manteniéndose la diferencia entre los modelos SM-2 y el ideal, hasta este momento, no significativas (p< 0,0001). En caso de extenderse la infusión a más de 6 h la Cp calculada en ese momento es de 0,3 µg/mL y a pesar de diferenciarse de la determinada al haber transcurrido los primeros 30 min de infusión (Cp30min = 0,29 mcg/ml) en solo 0,1µ/mL, la diferencia es, entre SM-2 y el modelo ideal, muy significativa estadísticamente (p< 0,0001). Sin embargo, hay que tener en cuenta que la ketamina cuenta con metabolitos activos que pueden suplir esta diferencia lo cual puede ser una hipótesis si en trabajos futuros se pretendiera caracterizar el efecto analgésico de la ketamina al ser empleada con esta estrategia de administración en comparación con otra que sostenga la Cp(t).
Se concluye que la variación de la Vinf(t) es variable. Que el mantenimiento invariable de la Vinf(tn)de ketamina según los cálculos establecidos para la TIVA manual (modelo monocompartimental) produce incremento de la Cp, con diferencias estadísticamente significativa respecto al modelo ideal. Además, se concluye que el decrecimiento de la Vinf(tn) mediante la variante de cálculo Vinf (tn)=V inf (tn-1) x 0,85 luego del decrecimiento durante las primeras 6 h y al sostenerse posteriormente constante la V inf(tn), posibilita una mejor estabilidad de la Cp, según las simulaciones realizadas empleando el modelo de Domino, y resultaron sus diferencias estadísticamente no significativas con respecto al modelo ideal por un período de 6 h.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Sánchez OD, Boltó MV. Estudio comparativo de errores con prescripción electrónica versus prescripción manual. Farm Hosp. 2005;29(4):228-35.
2.Keohane CA. Seguridad de los medicamentos. Obstet Gynecol Clin (N Am). 2008:37-52.
3. Sepúlveda P. Midazolam en TIVA. En: Voullième PS. La anestesia intravenosa II. Actualizaciones en modelación. Santiago de Chile. 2006. Salacienos SA ed. pp. 54-59.
4. Rosa J, Navarrete V. Variante de cálculo de infusión de midazolam en la TIVA manual. Rev Cuba Anestesiol Reanim. 2013;12(3):198-209.
5. Sepúlveda P. Predictibilidad farmacológica y TIVA. En: Sepúlvea P. La Anestesia Intravenosa II. Actualizaciones en modelación, drogas y tecnologías complementarias. 1ª ed. Santiago de Chile: Salacienos SA ed; 2006. p. 59-91.
6. Abad A. Sistemas de infusión. Oxygen Disseny. En: Aguilera L. Anestesia total intravenosa. Principios básicos. Barcelona: España. 2009. p. 87-102.
7. Gan T. Target-controlled infusions for intravenous aesthetics. Anesthesiology. 2003;99:1039-42.
8. Kayvan Moussavi BM. Safety of continuous intravenous ketamine in adult and pediatric patients. Critical Care Medicine. 2018;46(1(Supl)).
9. Dahan FHM. Anomalies in target-controlled infusion: an analysis after 20 years of clinical use. Anaesthesia. 2018.
10. Absalom AR, Menon MLD, Menon K, Sharar SR, De Smet T. Predictive performance of the Domino, Hijazi, and Clements models during low-dose target-controlled ketamine infusions in healthy volunteers. Br J Anaesth. 2007;98(5):615-23.
11. Egan T. Advances in the clinical pharmacology of intravenous anesthetics: Pharmacokietic pharmacodinamic, pharmaceutical and technological considerations. ASA Refhesers Courses (USA). 2004;24:71-83.
12. Navarrete V. La alternativa de la ketamina. Rev Mexicana Anest. 2014;37(1):243-50.
13. Linda L, Visides PE. Ketamine: 50 years of modulating the mind. Frontiers in Human Neuroscience. 2016;10(article 612).
14. Abramowitz M, Stegun IA. Exponential Function. En: Abramowitz M. Handbook of mathematical functions. Dover: New York; 1972. p. 69-71.
15. Navarrete V. Matemática esencial para farmacología Clínica. En. Sepúlveda P. La Anestesia Intravenosa (o Endoflevosa) Visiones Históricas y Futuras 2014. 1ª ed. Santiago de Chile: Salacienos SA ed; 2006. p. 27-54.
16. Navarrete V. Anestesia Intravenosa. En: Cabo de Vila E. Anestesiología Clínca. 2ª ed. ECIMED: La Habana; 2014. p. 99-134.
17. Coburn M, Sanders RD. Does pharmacokinetic/pharmacodynamic model -guided anaesthesia improve outcome after hip fracture surgery. Br J Anaesth. 2017:119(5):872-73.
18. Goldstein L, Schneider A. Brief calculus and its applications. Función exponencial. 11th ed. USA: Prentice-Hall ed; 2006. p. 177-200.
Recibido: 24 de
abril de 2018.
Aprobado: 20 de
mayo de 2018.
Víctor
Navarrete Zuazo. Clínica Central Cira García. La Habana, Cuba.
Correo electrónico: victornz1@gmail.com