Revista Cubana de Anestesiología y Reanimación. 2014;13;(1)
ARTÍCULO DE REVISIóN
Control perioperatorio de la anticoagulación en el paciente con prótesis valvular para cirugía no cardiaca
Preoperative control of anti coagulation in patients with valvular prosthesis for non cardiac surgery
Dr. Antonio de Arazoza HernándezI, Dra. Elizabeth Rodríguez RosalesII, Dr. Fausto Leonel Rodríguez SalgueiroIII, Dr. Raúl Cruz BouzaIV, Dr. Amaury Fernández MolinaIII
I Centro de Investigaciones Medico Quirúrgicas (CIMEQ). La Habana, Cuba.
II Unidad de Cuidados Coronarios. Hospital clinoquirúrgico "Joaquín Albarrán". La Habana, Cuba.
III Instituto de Cardiología y Cirugía Cardiovascular. La Habana, Cuba.
IV Hospital clinicoquirúrgico «Hermanos Ameijeiras». La Habana, Cuba.
RESUMEN
Introducción: las terapias de anticoagulación y antiagregación son frecuentemente utilizadas en pacientes cardiópatas. La conducción anestésica de estos pacientes tiene peculiaridades que de no cumplirlas puede llevar a complicaciones severas o a la muerte del paciente. Objetivo: revisar la conducta anestésica ante un paciente cardiópata anticoagulado para cirugía no cardiaca electiva y de urgencia. Método: se hizo una revisión de las características del paciente cardiópata anticoagulado, se analizaron las causas de la anticoagulación y se valoró la interrupción o no del tratamiento anticoagulante ante procederes mayores, menores, electivos y urgentes. Se detalla la monitorización intraoperatoria y la reiniciación del tratamiento anticoagulante post-cirugía. Conclusiones: el éxito de la cirugía no cardiaca del paciente cardiópata anticoagulado, sólo es posible gracias al conocimiento y cumplimiento de las particularidades de estos pacientes. No es posible improvisar ante estos casos, que implican una gran responsabilidad médica y legal para el anestesiólogo.
Palabras clave: terapias de anticoagulación y antiagregación, cardiópatas.
ABSTRACT
Introduction: therapies of anti coagulation and anti aggregation are frequently used in cardiopath patients. The anesthetic conduction of these patients has some peculiarities which in case they are not fulfilled they may lead to severe complications or even the death of the patient. Objective: to revise the anesthetic conduct in front of cardiopath patients and is anti coagulated for elective or emergent non cardiac surgery. Method: a revision of the characteristics of this patient was carried out, the causes of anti coagulation were analyzed , the causes of anti coagulation were analyzed as well as the causes of anti coagulation and the interruption or not of the anti coagulant treatment ante main, minor, elective or urgent procedures. The intra operative monitoring is detailed and the reinitiating of post surgery anti coagulant treatment. Conclusion: the success of the non cardiac surgery of the cardiopath patient and takes an anti coagulant treatment is only possible thanks to the knowledge and fulfillment of particularities of this patient. It is not possible to improvise with these cases which explain a great medical legal responsibility for the anesthesiologist.
Keywords: anti coagulation and anti aggregation therapies, cardiopaths.
INTRODUCCIÓN
Las terapias de anticoagulación y antiagregación son frecuentemente utilizadas en pacientes con cardiopatías, ya sea para complementar el tratamiento de arritmias, la implantación de dispositivos como stents intracoronarios o intraaórticos, válvulas protésicas; en el tratamiento del infarto miocárdico agudo (IMA), tromboembolismopulmonar, etc. La conducción anestésica de estos pacientes tiene peculiaridades que de no cumplirlas puede llevar a severas complicaciones o a la muerte del paciente.
Conducta preoperatoria
En estos casos el trabajo en equipo es primordial, es necesario que todos los miembros del equipo quirúrgico conozcan que se operará un paciente con esas características para no dar lugar a la improvisación.
En el interrogatorio de un paciente que tiene colocada una prótesis valvular, que va a ser llevado a una cirugía no cardiaca, se deben conocer con claridad los siguientes aspectos:
Indicación de la sustitución valvular
Existen causas congénitas, que con la cirugía de reemplazo valvular quedaron completamente corregidas, pero también hay causas, mucho más frecuentes en el adulto, como son las degenerativas y las reumáticas, que no terminan con la cirugía de reemplazo y que puede acompañarse de daño en otras válvulas u otras estructuras cardíacas, que se deben sospechar y evaluar mediante un ecocardiograma previo a la cirugía mayor electiva.1
El tiempo de colocada la prótesis también es muy importante. Las prótesis cardíacas se epitelizan entre uno y tres años de colocadas y tienen menor riesgo de trombosis valvular. Por eso la mayoría de las trombosis valvulares ocurren antes del año de implantada la prótesis, mientras que las que ocurren después de los tres años se deben a abandono o irregularidades del tratamiento anticoagulante.2
La posición de la prótesis es el factor más importante a la hora de anticoagular al paciente. Las prótesis colocadas en posición mitral tienen un flujo más rápido a través de la misma, una gran diferencia de presiones entre la cavidad auricular y ventricular izquierda y generalmente la aurícula se distiende, fibrila y genera flujos lentos y turbulentos que favorecen la formación de trombos y fenómenos trombo-embólicos, y necesitan mayor nivel de anticoagulación (INR entre 3 y 3.5). En cambio, las prótesis valvulares colocadas en posición aórtica no tienen estos problemas y necesitan un nivel menor de anticoagulación (INR entre 2.5 y 3).3-5
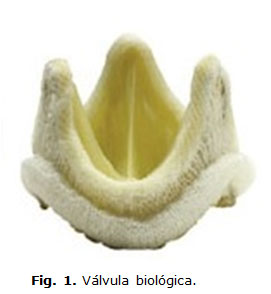
Es imprescindible conocer el tipo de prótesis que tiene colocada el paciente. Existen dos tipos de prótesis: biológicas y mecánicas. Las biológicas (figura 1) se fabrican de pericardio equino o bovino y por su corto tiempo de vida media (un promedio de 10 años, según de su ubicación) se colocan en mujeres en edad fértil que no han tenido hijos o en mayores de 70 años.

Estas válvulas biológicas requieren anticoagulación durante seis meses y antiagregación de por vida. Las válvulas mecánicas tienen tres generaciones y se anticoagulan de por vida. La válvula Starr Edwards (tipo bola en caja, ver figura 2) ya no se utiñliza en la actualidad, pero aún se encuenntran pacientes con ellas colocadas.

Válvula monolenticular
Esta válvula ocupa gran espacio muerto, genera flujo turbulento, provoca hemólisis y lleva gran anticoagulación. Posteriormente aparecieron las primeras válvulas de disco (monolenticulareso de un solo disco, (ver figura 3), que tampoco se colocan en la actualidad.
Válvula bilenticular
Generan un flujo lateralizado, turbulento y dirigido hacia una pared cardiaca, generan menor hemólisis y trombogenicidad y llevan una anticoagulación intermedia. Actualmente se colocan las válvulas bilenticulares (dos discos, ver figura 4) de apertura central, que generan un flujo laminar, central, no turbulento, escasa trombogenicidad y ninguna hemólisis, y la necesidad de anticoagulación es en dependencia de la posición en que está colocada la prótesis, como vimos anteriormente.2,3

El tamaño de la prótesis también es importante a la hora de anticoagular o revertir la anticoagulación de un paciente. Mientras menor sea el anillo de la prótesis, más rápido será el flujo a través de la misma y menor será la posibilidad de una trombosis valvular.3
Por último, se debe precisar la funcionalidad de la prótesis valvular. Debe realizarse un ecocardiograma intratorácico previo, buscando trombosis valvular, disfunción de prótesis, fugas paravalvulares y gradiente transvalvular. Se descartarán además alteraciones estructurales o funcionales en los aparatos valvulares nativos del paciente, como describimos anteriormente.2,3
Lo más importante a realizar en el periodo preoperatorio de un paciente portador de una prótesis valvular ante una cirugía no cardiaca es la interrupción del tratamiento anticoagulante, que se debe realizar de la siguiente forma, en dependencia de la prioridad (electiva o urgente) y el tipo (menor, mayor o de gran envergadura) de cirugía:3
1. Paciente portador de una prótesis valvular para cirugía electiva menor. En estos procedimientos quirúrgicos donde la hemorragia puede ser fácilmente controlada, incluida la extracción dentaria y procedimientos urológicos menores, no se requiere interrupción de la anticoagulación, permitiéndose reducir el INR hasta 2.0 6 (con grado de recomendación y nivel de evidencia 1C). Otros autores prefieren interrumpir los anticoagulantes orales tres días antes de la cirugía y reanudarlos dos días después de la misma7 (con grado de recomendación y nivel de evidencia 2C), por lo que sugerimos emplear la primera estrategia.
2. Paciente portador de una prótesis valvular para cirugía electiva mayor. En este tipo de procedimiento, donde la interrupción de la anticoagulación se considera esencial, deben ingresarse previamente (1A) y se reducirá el INR hasta 1.5 (1A) de la siguiente forma:6,7
§ Se suspenderá la anticoagulación oral siete días previo a la intervención quirúrgica y se iniciará anticoagulación con heparina de bajo peso molecular 2 dosis diarias por vía subcutánea, mínimo durante cinco días. Se cambiará la heparina de bajo peso molecular por heparina sódica a dosis de 50 mg cada seis horas, por vía subcutánea, mínimo por dos días. Se pondrá la última dosis la noche previa a la cirugía y se operará al día siguiente en el primer turno o bien se pone la última dosis en la mañana de la cirugía, se opera en cualquier turno y se revierte cuando sea necesario con sulfato de protamina 50 mg endovenoso lento (1:1). Se monitorizará el INR diariamente hasta la mañana de la intervención. Todas estas recomendaciones tienen un grado de recomendación y nivel de evidencia 2C.6,7
Los pacientes portadores de una plastia valvular o una prótesis biológica de más de tres meses de colocada, o del cierre de una comunicación interauricular con parche, que estén tomando salicilatos, pueden operarse de cualquier cirugía sin necesidad de retirar los mismos (2C).6, 7
3. Paciente portador de una prótesis valvular para cirugía urgente mayor. Ante un cuadro de solución quirúrgica inmediata en un paciente portador de una prótesis valvular, donde no haya tiempo de realizar los esquemas mencionados, entonces se administrará Vitamina K (ámpula de 10 mg) endovenoso, que es «antídoto» de la warfarina, aunque no repondrá los factores de la coagulación inactivados por la misma (2C).6, 7 Por ello se administrará plasma fresco congelado a razón de 1 unidad cada 10 kilogramos de peso del paciente, para aportar los factores de la coagulación inhibidos por la warfarina.(2C).6, 7 Se puede complementar con antifibrinolíticos (2C), 6, 7 como el ácido tranexámico (10-20 mg/Kg EV lento, previo a la cirugía, y repetir de idéntica forma, previo al cierre de la piel). Una opción mejor, aunque más cara y menos accesible será la aprotinina, en uno de sus tres esquemas recomendados. (2C).8,9
Una opción excelente es el Concentrado de Complejos Protrombínicosque aportará los factores II, VII, IX y X, que logrará una reversión eficaz de la anticoagulación en 10 minutos y durante 12 a 24 horas (con grado de recomendación y nivel de evidencia 2C). 6, 7. La dosis usual es de 20 - 40 UI/Kg, aunque se ha reportado el empleo de hasta 5 000 UI en pacientes con INR superiores a 5.0.9
Conducta postoperatoria: El error más frecuente en la conducta anestésica en estos pacientes no está en lo que hemos explicado hasta aquí, sino que el verdadero peligro reside en el reinicio de la anticoagulación. 17 Si se anticipa interfiere en la cicatrización de la herida quirúrgica, si se retrasa puede ocurrir la temida trombosis protésica, que de ocurrir en el periodo postoperatorio inmediato, junto con la reintervención subsecuente, casi siempre conllevan la pérdida del paciente. 18 El esquema recomendado es el siguiente:
Se reiniciará la administración de heparinas de bajo peso molecular a las 12 horas de la intervención quirúrgica (1A), 6, 7 y no se retirarán hasta no haber alcanzado otra vez el INR terapéutico indicado para cada caso con los anticoagulantes orales (1A).6,7
La anticoagulación oral debe reiniciarse lo antes posible. Se aconseja comenzar con warfarina (tabletas de 2 y 10 mg) a dosis de 0.1 mg /Kg de peso a las 48 horas de la operación (1A), 6, 7. Se mantendrán luego a las dosis habituales del preoperatorio del paciente (1A).6,7
Es aconsejable realizar el postoperatorio inmediato (las primeras 24 horas) de estos pacientes en una sala cerrada, puede ser la Unidad de Cuidados Posanestésicos, o una Unidad de Cuidados Intermedios Quirúrgicos.19 Se medirá el gasto de los drenajes quirúrgicos (volumen contra tiempo); se prestará especial atención a la analgesia, ya que el dolor genera descarga de catecolaminas que aumentan la frecuencia cardíaca y la tensión arterial y aumenta las posibilidades de sangrado. La monitorización será la continuación de la empleada en el intraoperatorio, así como la terapia con líquidos.20
Estos pacientes deben ser interconsultados con el cardiólogo antes de las 24 horas después del proceder quirúrgico, o como mínimo, debe repetirse el ecocardiograma, para descartar la disfunción de prótesis.
Se concluye que el éxito de la cirugía no cardiaca del paciente cardiópata anticoagulado, sólo es posible gracias al conocimiento y cumplimiento de las particularidades de estos pacientes. No es posible improvisar ante estos casos, que implican una gran responsabilidad médica y legal para el anestesiólogo.
REFERENCIAS BIBLIOGRÁFiCAS
1. Bonow RO, Carabello BA, Chatterjee K et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease. J Am Coll Cardiol 2006;48:1148.
2. Rahimtoola SH. Choice ofprosthetic heart valve for adult patients. J Am Coll Cardiol 2003;41:893904.
3. Rahimtoola SH. The year in valvular heart disease. J Am Coll Cardiol 2005;45:11122.
4. Carabello B.A.: Clinicalpractice. Aortic stenosis. N Engl J Med 2002; 346:677.
5. Carabello B.A.: The pathophysiology of mitral regurgitation. J Heart Valve Dis 2000; 9:600.
6. Guyatt GH. Executive Summary. Therapy and prevention of thrombosis, 9th edition. American College of Chest Physicians. Evidence-Based Clinical Practice Guidelines. Chest 2012;141;7S-47S. En línea. [Consultada agosto 15, 2013]. URL disponible en: http://chestjournal.chestpubs.org/content/141/2_suppl/7S.full.html
7. Holbrook A, Schulman S, Witt DM, et al. Evidence-based management of anticoagulant therapy: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141(2)(suppl):e152S-e184S.
8. Ufer M. Comparative pharmacokinetics of vitamin K antagonists: warfarin, phenprocoumon and acenocumarol. Clin Pharmacokinet. 2005;44:1227-46.
9. Palareti G, Cosmi B. Bleeding with anticoagulation therapy Who is at risk, and how best to identify such patients. Thromb Haemost. 2009;102(2):268-78.
10. Hannan E.L., Kilburn Jr. H., O'Donnell J.F., et al: Adult open heart surgery in New York State: An analysis of risk factors and hospital mortality rates. JAMA 1990; 264:2768.
11. Crescenzi G., Scandroglio A.M., Pappalardo F., et al: ECG changes after CABG: The role of the surgical technique. J Cardiothorac Vasc Anesth 2004; 18:38.
12. ACC/AHA: 2007 Guidelines on perioperative cardiovascular evaluation & care for noncardiac surgery. J Am Coll Cardiol 2007; 50:1707-1732.
13. Warkentin TE, Crowther MA. Reversing anticoagulants both old and new. Can J Anaesth 2002; 49:S11.
14. Dorje P, Tremper K. Systolic pressure variation: A dynamic measure of the adequacy of intravascular volume. Semin Anesth Periop Med Pain 2005; 24:147.
15. Vender J.: Pulmonary artery catheter utilization: The use, misuse, or abuse. J Cardiothorac Vasc Anesth 2006; 20:295-299.
16. American Society of Anesthesiologists Task Force on Pulmonary Artery Catheterization: Practice guidelines for pulmonary artery catheterization: An updated report by the American Society of Anesthesiologists Task Force on Pulmonary Artery Catheterization. Anesthesiology 2003; 99:988.
17. Spiess BD, Gillies BS, Chandler W, Verrier E. Changes in transfusion therapy and reexploration rate after institution of a blood management program in cardiac surgical patients. J Cardiothorac Vasc Anesth 1995; 9:168.
18. Bonow RO, Picone AL, McIntosh CL, Jones M, Rosing DR,Maron BJ et al. Survival and functional results after valve replacementfor aortic regurgitation from 1976 to 1983. Impact ofpreoperative left ventricular function. Circulation 1985; 72:1244-1256.
19. Kaplan, JA. Essentials of Cardiac Anesthesia, 1st ed. 2008. Ed. Saunders. New York. pp 123-134.
20. DiNardo JA, Zvara DA. Anesthesia for Cardiac Surgery. Third ed, 2008.Published by Blackwell Publishing Inc, 350 Main Street, Malden, Massachusetts 02148-5020, USA. pp. 334-342.
Recibido: Septiembre 20, 2013 Modificado: Octubre 9, 2013 Aprobado: Noviembre 6, 2013Dr. Antonio de Arazoza Hernández. Centro de Investigaciones Medico Quirúrgicas (CIMEQ). La Habana, Cuba. Correo electrónico: dearazoza@infomed.sld.cu