ARTÍCULO ORIGINAL
Coagulopatía asociada a la cirugía espinal mayor
Major spinal surgery-associated coagulopathy
Maria Oslaida Agüero Martínez1 Dra. Idoris Cordero Escobar2, Lucas Cordovi de Armas1 Dr. Ydris Añuez Castillo3, Dra. Ángela Gutiérrez Rojas4
Hospital Clínico Quirúrgico Hermanos Ameijeiras.
1Especialistas de II en Anestesiología
y Reanimación. MsC. Profesora Auxiliar. Hospital Hermanos Ameijeiras.
Ciudad Habana.
2Especialista de II en Anestesiología
y Reanimación. Profesora Titular. Dra. en
Ciencias. Hospital Hermanos Ameijeiras. Ciudad Habana. 3Especialistas
de I en Anestesiología y Reanimación. Hospital Hermanos Ameijeiras.
Ciudad Habana.
4Especialista de II grado en
Bioestadística. Profesora Auxiliar. Hospital Hermanos
Ameijeiras. Ciudad Habana.
RESUMEN
Introducción: Los trastornos de la coagulación que ocurren durante la cirugía espinal mayor para la escoliosis, suelen ser muy comunes; sin embargo los pacientes que llegan a desarrollar manifestaciones clínicas de Coagulación Intravascular Diseminada durante tales intervenciones representan solo un pequeño porcentaje. La monitorización perioperatoria de los factores de la coagulación en este ámbito nos ayudaría a identificar enfermos con mayor riesgo de presentación del síndrome y realizar un diagnóstico oportuno con una terapéutica consecuente. Objetivos: Identificar la frecuencia de aparición de Coagulación Intravascular Diseminada en la cirugía espinal mayor. Métodos: Se estudio una muestra de 19 pacientes. Se registraron las variables: Estudios de la coagulación, Hematocrito, Pérdidas sanguíneas, Tiempo quirúrgico, Tipo de escoliosis y Diagnóstico de Coagulación Intravascular Diseminada. Resultados: El sexo femenino predomino (68. 4 %), la escoliosis Idiopática fue el diagnóstico más frecuente. Las pruebas de coagulación sanguínea se modificaron en 100% de los pacientes. El momento de mayor variabilidad fue el período posterior a la decorticación ósea. Los pacientes con diagnóstico de escoliosis neuromuscular presentaron pérdidas sanguíneas mucho mayores, asociadas a una mayor variabilidad de las pruebas de coagulación y a la magnitud del tiempo quirúrgico. Conclusiones: El total de los enfermos estudiados presentaron trastornos de la coagulación. La incidencia de Coagulación Intravascular Diseminada fue baja.
Palabras claves: Coagulación intravascular diseminada, Trastornos de la coagulación, Cirugía espinal mayor.
ABSTRACT
Introduction: Coagulation disorders present during major spinal surgery due to scoliosis are commonest; however, patient may to develop clinical manifestations of disseminated intravascular coagulation (DIVC) present during such interventions represent only a small percentage. Perioperative monitoring of coagulation factors in this setting will allow us to identify patients with a high risk of suffer this syndrome and to made an appropriate diagnosis using a suitable therapy. Objectives: to identify the appearance frequency of DIVC in the major spinal surgery. Methods: A sample including 19 patients was studied registering the following variables: coagulation studies, hematocrit, blood losses, surgical time, the type of scoliosis and the DIVC diagnosis. Results: There was predominance of female sex (68,4%), idiopathic scoliosis was the most frequent diagnosis. Blood coagulation tests were modified in the 100% of patients. The most variable moment was the post-bone decortications period. Patients diagnosed with neuromuscular scoliosis had higher blood losses, associated with a greater variability of the coagulation tests and with the surgical time magnitude. Conclusions: All study patients had coagulation disorders. The DIVC incidence was low.
Key words: Disseminated intravascular
coagulation, coagulation disorders, and major spinal surgery.
INTRODUCCIÓN
Los trastornos de la coagulación que ocurren durante la cirugía espinal mayor, suelen ser más comunes de lo que en realidad pensamos; sin embargo, se dice que los pacientes que llegan a desarrollar manifestaciones clínicas de coagulación intravascular diseminada (CID) durante este tipo de proceder representan solo un pequeño porcentaje, pues la misma es la complicación mayor de estos trastornos.1,2
El mecanismo para el desarrollo de una CID durante la instrumentación espinal mayor aún no está bien definido. La primera publicación acerca del desarrollo de una CID en relación con la intervención quirúrgica espinal mayor, se realizó en 1974 por Philip, Mayer y Janet 1, ellos llegaron a la conclusión en su investigación que el mayor factor etiológico para desarrollar CID es el daño que se produce durante la cirugía a músculos, hueso y sangre. De esa fecha a la actualidad se han publicado pocos resultados.
Jacobs, Asher y Gilbert 3 demostraron en su investigación una pobre correlación entre la aparición de este síndrome y un balance de fluidos positivos. Raphael, Lacker y Engler 4 sugirieron que esta diátesis hemorrágica está relacionada con la decorticación del hueso que trae consigo una exposición masiva de extensas áreas de médula ósea y produce una superficie de contacto que estimula el sistema intrínseco de la coagulación, además la liberación de partículas durante esta manipulación ósea, como la tromboplastina, que pueden acelerar la coagulación a través de la estimulación de la vía extrínseca.
En 1978, Siegal, Seligsohn, Aghai y Modan 5 realizaron un análisis retrospectivo de 118 pacientes, basados en criterios de laboratorio, para determinar la frecuencia de distribución de este síndrome y sus posibles etiologías. En 1982 otro estudio 2 publicó la aparición de este síndrome en dos casos con diagnostico de escoliosis idiopática, durante la intervención quirúrgica correctora de la deformidad.
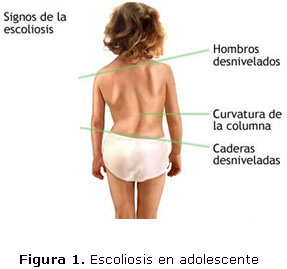
La cirugía de corrección de la escoliosis es la principal causa de cirugía de columna en niños y adolescentes. La escoliosis (Figura 1) se define como la curvatura lateral de la columna vertebral mayor a 40 grados, medidos según el método de Cobb en una radiografía de pie. (Figura 2). Además se produce rotación de ésta, con compromiso variable de la parrilla costal. Su incidencia alcanza de 1,8 a 4,0 en 10.000 y se presenta en mujeres con una frecuencia más de diez veces mayor que en hombres (3,9/1.000 y 0,3/1.000 respectivamente). 6
Las técnicas quirúrgicas más utilizadas para su corrección, estabilización y fusión son: las descritas por Harrington en 1962, Galveston - Luque en 1973 y desde los años ochenta la instrumentación más usada es la de Cotrel-Dubousset o variaciones de ésta, la cual consiste en un sistema de instrumentación segmentaria que tiene capacidad de corrección tridimensional de la curva escoliótica y no requiere de inmovilización postoperatoria. Su colocación se realiza a través de una incisión en la línea media separando los tejidos blandos de las apófisis espinosas, facetas y apófisis transversas. Se colocan ganchos y tornillos pediculares de los cuales se anclan dos barras de titanio que se estabilizan con puentes metálicos entre ambas. Posteriormente se realiza una decorticación de todos las vértebras y facetas y se coloca injerto óseo obtenido de cresta ilíaca, de las costillas resecadas durante la toracoplastia si ésta se ha realizado previamente, o de hueso de banco. La instrumentación Galveston-Luque es también una artrodesis segmentaria y consta de dos barras metálicas que se anclan en el sacro o hueso ilíaco y luego se fijan mediante alambres alrededor de las láminas de cada segmento artrodesado. Aquí también se realiza decorticación y destrucción de las articulaciones facetarias y colocación de injerto óseo obtenido de las apófisis espinosas, crestas ilíacas o hueso de banco.6
Estos procederes conllevan una agresión de gran magnitud. Por todo lo anterior mencionado existe la posibilidad real de desarrollo de una CID, la cual puede provocar una hemorragia, muchas veces inesperada y excesiva.6,7
La monitorización perioperatoria de los factores de la coagulación en este tipo de cirugía nos ayudaría a identificar cuales son aquellos pacientes con grandes riesgos de desarrollar el síndrome, además nos permitiría realizar un diagnostico oportuno e instaurar una pronta terapéutica.
Fueron objetivos de esta investigación identificar la frecuencia de aparición de CID en la cirugía espinal mayor, así como las modificaciones perioperatorias de las pruebas de coagulación sanguínea. Si la variación de las pruebas de la coagulación está en correspondencia con el acto quirúrgico. Determinar la incidencia de aparición de CID en todos los pacientes con variabilidad en las pruebas de coagulación sanguínea y si existe correlación entre la etiología de la escoliosis, el tiempo quirúrgico, la variabilidad de las pruebas de coagulación y el volumen total de sangramiento.
MATERIAL Y MÉTODOS
Se realizó un estudio prospectivo longitudinal y descriptivo que incluyó 19 pacientes, propuestos para cirugía del raquis en el servicio de Anestesiología y Reanimación del Hospital Clínico Quirúrgico Hermanos Ameijeiras, en el período comprendido entre Enero del 2004 y Diciembre del 2006.
CRITERIOS DE INCLUSIÓN
Pacientes programados para CEME, con clasificación del Estado Físico ASA I y II. Edades límites 20 - 45 años. Peso 45 - 75 Kg. Diagnóstico de escoliosis y con consentimiento informado del enfermo.
CRITERIOS DE EXCLUSIÓN
Antecedentes de coagulopatía ya definida y afecciones hepáticas y renales.
CRITERIOS DE SALIDA
Decisión expresa del enfermo de abandonar el estudio, así como complicaciones derivadas de la técnica anestésica y complicaciones sistémicas que cancelen la intervención.
Los pacientes fueron evaluados por un Anestesiólogo quien en consulta preoperatoria los incluyo en el estudio, según criterios.
Una vez en el quirófano a todos los enfermos, después de canalizar vena periférica, se les administró como medicación preoperatoria una dosis de midazolan de 0.2 mg/ Kg.
Se realizó monitorización intraoperatoria de los siguientes parámetros:
• Presión arterial media (PAM)
• Presión venosa central (PVC)
• Electrocardiografía (ECG)
• Gasto urinario
• Gases arteriales, electrolitos, hematocrito y parámetros de la coagulación...
La inducción de la anestesia se realizó en este orden y con las siguientes drogas:
Lidocaína al 2 % de 1.5 mg / Kg . Bromuro de Pancuronio de 0.06 mg / Kg, Propofol 2.5 mg / Kg. Fentanil 10 µg / Kg y Succinilcolina 1 mg / Kg
Después de transcurridos 60 segundos de la inyección de succinilcolina se procedió a la colocación del tubo endotraqueal. La ventilación pulmonar mecánica se efectúo con un ventilador volumétrico Servo 900 C. Volumen corriente equivalente a 8 ml / Kg. y una frecuencia respiratoria de 14 ciclos por minutos. Los gases empleados fueron oxigeno al 100 % durante la inducción de la anestesia y óxido nitroso más oxigeno durante la ventilación intra operatoria con una fracción inspirada de este último de 0.35. El mantenimiento de la anestesia se realizó con dosis suplementarias de fentanil 3 mcg / Kg. y bromuro de pancuronio 0.03 MG / Kg. Según necesidad.
Se tuvo en cuenta que en este tipo de intervención quirúrgica las pérdidas sanguíneas son significativas, por lo que apoyados en la existencia de una gran variedad de técnicas de ahorro de sangre 8-10 nosotros decidimos utilizar de forma combinada dos de ellas:
• Hipotensión controlada: Este cambio hemodinámico se logró con el empleo de infusión continua de nitroglicerina a dosis respuesta dentro de un rango terapéutico (0.1 a 5 microgramos /Kg. / min.). Se llevó la PAM a cifra de 60 mmHg.
• Fármacos hemostáticos: Se administró una dosis de ácido épsilon aminocaproico de 75 mg/Kg. 30 minutos antes y después de la cirugía.
Se calculó la perdida sanguínea aceptable 9 a cada paciente incluido en nuestro estudio y la reposición se realizó con los mismos tipos de soluciones para todos los enfermos (Cristaloides: Ringer Lactato, Coloide sintético: Haemacel, Coloide natural: Albúmina humana 20 %), de la siguiente forma:
• Si la pérdida sanguínea del paciente fue menor de un tercio del valor de la pérdida sanguínea calculada: cristaloides.
• Si la pérdida sanguínea del paciente fue mayor de un tercio del valor de la pérdida sanguínea calculada: coloide.
• Si la pérdida sanguínea del paciente superó el valor de la pérdida sanguínea calculada: concentrado de hematíes.
Las variables a medir fueron:
1. Estudios de la coagulación:
• Conteo de plaquetas
• Tiempo de protrombina (TP)
• Tiempo parcial de tromboplastina activada (TPT)
• Cuantificación del fibrinógeno (F)
• Productos de degradación del fibrinógeno (PDF)
• Dímero D
2. Hematocrito. Esta primeras dos variables se midieron en seis momentos fundamentales: Preoperatorio (M1), previa a la decorticación ósea (M2), posterior a la decorticación (M3) y a las 8 (M4), 16 (M5) y 24 (M6) horas del postoperatorio.
3. Perdidas sanguíneas intra operatorias en tres momentos:
• Previo a la decorticación ósea (M1).
• Durante decorticación ósea (M2).
• Posterior a la decorticación ósea.
Las mismas fueron cuantificadas por aspiración y por compresas. Para medir las pérdidas por compresas se utilizó el método gravimétrico, que consiste en pesar las mismas antes de ser utilizadas y después de la intervención quirúrgica. Por cada gramo de más que pesó la compresa se calculó 1 ml de sangre pérdida. Este método tiene el inconveniente que al colocar las compresas en el compresero el agua se evapora y esto trae como consecuencia que haya una inexactitud en el cálculo del volumen de sangre perdida.
4. Tiempo quirúrgico.
5. Tipo de escoliosis
6. Diagnóstico de Coagulación intravascular diseminada (CID): Se basó en los siguientes criterios 11
• Conteo de plaquetas < 100.000/ Mm. 3
• Fibrinógeno < 90 mg/ dl
• Tiempo de protrombina >1.5 segundos , comparado con el control
• Tiempo parcial de tromboplastina > 1.3 segundos, comparado con el control
• Tiempo de trombina > 17 segundos.
• Productos de degradación del fibrinógeno >20 µg/ml
• Dímero D Positivo >0.5 µg/ml
Todos los datos fueron recogidos en un modelo. Se efectuaron cálculos de estadígrafos descriptivos. Para variables categóricas se calcularon los porcentajes y para las cuantitativas las medidas de tendencia central (media y mediana), desviación típica e intervalos de confianza para las medidas.
RESULTADOS
El total de pacientes estudiados fueron 19. Predominó el sexo femenino con una frecuencia de 13 (68,4 %) y para el masculino fue de 6 (31, 6%).
La etiología del tratamiento quirúrgico fue Escoliosis Idiopática en 11 pacientes (57,9%) y Escoliosis Neuromuscular en 8 (42,1 %).
El tiempo quirúrgico vario de un mínimo de 3 horas a un máximo de 10 horas con una media de 4,89.
Las pruebas de coagulación sanguínea se modificaron en 100 % de los pacientes. El momento de mayor variabilidad fue el período posterior a la decorticación ósea durante el cual coincidió también la mayor pérdida sanguínea (entre 700 y 1000 ml) y la menor disminución del hematocrito (15 %). (Tablas 1 y 2).
Tabla 1. Sangrado
perioperatorio
|
Media. Sangramiento Perioperatorio
|
|||||
|
|
N |
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
|
Sangrado 1 |
19
|
100
|
300
|
192,11
|
80,386
|
|
Sangrado 2 |
19
|
200
|
1000
|
531,58
|
263,107
|
| Sangrado 3 |
19
|
200
|
700
|
342,11
|
153,897
|
| Total |
19
|
500
|
2000
|
1068,42
|
451,605
|
| N válido (según lista) |
19
|
||||
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
Tabla 2. Variabilidad
del Hematocrito
|
|
N |
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
|
HTO 1 |
19
|
38
|
45
|
40,37
|
2,629
|
|
HTO 2 |
19
|
30
|
43
|
36,37
|
3,353
|
|
HTO 3 |
19
|
15
|
38
|
26,84
|
6,336
|
|
HTO 4 |
19
|
18
|
35
|
27,84
|
4,413
|
|
HTO 5 |
19
|
20
|
36
|
28,89
|
3,784
|
|
HTO 6 |
19
|
19
|
36
|
30,11
|
3,755
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
En la tabla 3, se puede observar la evolución del recuento plaquetario, el cual descendió de una media de 247.47 x 109 en el período preoperatorio a 135. 37 x 109 en el período posterior a la decorticación ósea, momento en el cual obtuvo su valor mínimo (30.000 Mm. 3)
Tabla 3. Variabilidad
del Recuento plaquetario
|
Media. Sangramiento Perioperatorio
|
|||||
|
|
N |
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
|
Plaquetas 1 |
19
|
175
|
350
|
274,47
|
47,723
|
|
Plaquetas 2 |
19
|
150
|
300
|
231,05
|
56,139
|
|
Plaquetas 3 |
19
|
30
|
250
|
135,37
|
55,160
|
|
Plaquetas 4 |
19
|
50
|
250
|
139,47
|
52,860
|
|
Plaquetas 5 |
19
|
65
|
300
|
166,63
|
65,269
|
|
Plaquetas 6 |
19
|
60
|
300
|
190,32
|
59,747
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
En las tablas 4, 5 y 6 se presenta la evolución del tiempo de protrombina, el tiempo parcial de tromboplastina activada y del fibrinógeno, respectivamente. Todos estos parámetros de la coagulación presentaron su valor más crítico en el período posterior a la decorticación ósea y llegaron a la normalidad paulatinamente en la mayoría de los casos (78.9 %) a partir de las primeras 48 horas del postoperatorio.
Tabla 4. Variabilidad
del Tiempo Parcial de Protrombina
|
|
N
|
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
| TP_1 |
19
|
11,7
|
19,9
|
15,521
|
2,0970
|
| TP_2 |
19
|
12,2
|
20,9
|
16,332
|
2,4799
|
| TP_3 |
19
|
15
|
80
|
25,33
|
15,654
|
| TP_4 |
19
|
15,0
|
90,0
|
26,732
|
18,2892
|
| TP_5 |
19
|
15
|
90
|
23,71
|
17,037
|
| TP_6 |
19
|
14
|
90
|
22,10
|
17,314
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
Tabla 5. Variabilidad
del Tiempo Parcial de Tromboplastina activada
|
|
N
|
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
|
TPTK_1 |
19
|
25
|
49
|
39,87
|
6,477
|
|
TPTK_2 |
19
|
30
|
62
|
43,71
|
7,520
|
|
TPTK_3 |
19
|
38
|
160
|
62,32
|
28,290
|
|
TPTK_4 |
19
|
36
|
120
|
58,59
|
27,979
|
|
TPTK_5 |
19
|
34
|
120
|
54,84
|
29,325
|
|
TPTK_6 |
19
|
30
|
120
|
81,90
|
93,381
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
Tabla 6. Variabilidad
del Fibrinógeno.
|
|
N
|
Mínimo
|
Máximo
|
Media
|
Desv. típ.
|
|
Fibrinógeno 1 |
19
|
250
|
450
|
337,11
|
49,112
|
|
Fibrinógeno 2 |
19
|
225
|
363
|
302,00
|
47,357
|
|
Fibrinógeno 3 |
19
|
70
|
350
|
192,63
|
85,169
|
|
Fibrinógeno 4 |
19
|
60
|
350
|
182,89
|
85,201
|
|
Fibrinógeno 5 |
19
|
60
|
350
|
223,58
|
74,811
|
|
Fibrinógeno 6 |
19
|
60
|
360
|
251,58
|
70,239
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
Se constató que aquellos pacientes con diagnóstico de escoliosis neuromuscular presentaron pérdidas sanguíneas mucho mayores, asociadas a una mayor variabilidad de las pruebas de coagulación. Aspectos estos que aumentaron medida que se prolongó el tiempo quirúrgico. (Tabla 7)
Tabla 7. Relación
entre etiología, variabilidad de pruebas coagulación, sangramiento
total y tiempo quirúrgico. (Media)
| Etiología |
N
|
T Q
|
Plaquetas
|
TP
|
TPT
|
Fibrinógeno
|
Sangramiento
|
| Idiopática |
11
|
3.8
|
135.37
|
33.71
|
62.32
|
203.88
|
777.27 ml
|
| Neuromuscular |
8
|
6.37
|
115
|
46.7
|
81.90
|
102.89
|
1437.5 ml
|
Fuente: procesamiento estadístico a partir del modelo de recolección de datos
El total de los enfermos estudiados presentaron trastornos de la coagulación, pero la incidencia de CID no es significativamente elevada, 4 pacientes, lo que representó 21.01 % (p=0.1180 con un intervalo de confianza del 95%). Los mismos desarrollaron un sangrado masivo que comenzó luego de la decorticación de los procesos espinosos y uniones facetarias. En este momento el perfil de coagulación mostró disminución severa del recuento plaquetario y del fibrinógeno en asociación con un aumento de PDF y un Dímero D positivo. En tres de estos casos el sangrado cesó en pocas horas, después de la rápida corrección de los parámetros de la coagulación; pero uno de ellos falleció (5.3 %) en las primeras 4 horas del postoperatorio.
DISCUSIÓN
La anestesia para la corrección quirúrgica de las deformidades del raquis representa un reto al anestesiólogo por las complicaciones que de ello se derivan. Las alteraciones de la coagulación y el sangrado excesivo, son los riesgos más frecuentes e importantes. Durante estas intervenciones se pueden apreciar pérdidas sanguíneas iguales ó que exceden el volumen sanguíneo calculado para el paciente. 1,2 10,12-14
En este estudio predominó el sexo femenino, aspecto que coincide con la literatura revisada. Metrz 15 en su artículo ¨Manejo anestésico de cirugía de escoliosis¨, planteó que ésta es una enfermedad que se presenta en mujeres con una frecuencia más de diez veces que en hombres (3,9/1.000 y 0,3/1.000 respectivamente).
El proceso de la coagulación requiere de una intensa interacción y un normal funcionamiento de varios componentes, dentro de los cuales están incluidos las plaquetas, el endotelio vascular y las glicoproteínas del plasma (factores de la coagulación). Nuestros resultados reflejaron que existió una variabilidad de las pruebas de coagulación en 100 % de los casos y que la misma fue mayor en el período posterior a la decorticación ósea.
Algunos trabajos revisados concuerdan con el hecho de que el daño hístico producido en este tipo de cirugía es el responsable de la modificación de las pruebas de coagulación y fibrinolísis. Taylor, Toh, Hoots, Wada y Levi 14 investigaron las consecuencias de la Hemodilución normovolemica aguda en la hemostasia (TP. TPTK, complejo trombina-antitrombina III, Dímero D, complejo alfa 2 plasmina- antiplasmina), durante cirugía espinal mayor; y no encontraron diferencias estadísticamente significativas entre el grupo hemodiluido y el control en cuanto a variación en dichas pruebas, es decir en ambos grupos hubo una variabilidad significativa de las mismas. Concluyeron que la injuria secundaria a decorticación ósea es el factor desencadenante para el desarrollo de la fibrinolísis.
Por su parte Fengyu, Cammisa, Sandhu, Girardi y Khan 16 estudiaron un total de 10 pacientes entre 11 y 28 años de edad, que fueron sometidos a cirugía correctora de escoliosis y publicaron que este tipo de proceder se acompaña de una degradación importante del fibrinógeno, fundamentalmente en el periodo posterior a la decorticación ósea y en las primeras 24 horas del postoperatorio.
Las escoliosis se pueden clasificar en siete grupos etiológicos y es la idiopática del adolescente la más frecuente, con una prevalencia de 2-3 % en la población de 10 a 16 años. 17. En este estudio esta fue la etiología que predominó. En 42.1 % de nuestros casos la causa de la escoliosis estuvo asociada a enfermedad neuromuscular. La magnitud del sangramiento en los mismos fue mayor (media de 1437.5 ml). En este tipo de pacientes, a los cambios esqueléticos se vinculan alteraciones propias de éstas enfermedades como son: trastorno del control ventilatorio central, de la inervación supraespinal de las motoneuronas de los músculos respiratorios y pérdida de la función muscular (ya sea por lesiones de motoneuronas y nervios periféricos o por miopatías). Por ello tienen una mayor predisposición a complicaciones perioperatoria; las más frecuentes incluyen los sistemas respiratorio y cardiovascular, además del sangrado que está estrechamente vinculado con el tiempo quirúrgico y el traumatismo hístico.1,3,14,17,18
Kannan, Meert, Mooney, Hillman, Carol y Warrier 19 en un total de 25 pacientes (11 con diagnóstico de escoliosis neuromuscular y 14 idiopática), analizaron la relación existente entre la etiología de la escoliosis, pérdidas sanguíneas perioperatorias y trastorno de los parámetros de la coagulación y demostraron que la enfermedad neuromuscular se asocia con una mayor pérdida sanguínea, unido a un TP prolongado, con una considerable disminución del factor VII, lo cual sugiere una activación del sistema extrínseco de la coagulación. A la misma conclusión arribaron Fox, Thomas y Thompson 20, en un estudio de 90 pacientes. Concluyeron que a pesar de la utilización de diferentes métodos de ahorro de sangre, en aquellos casos con diagnóstico de escoliosis neuromuscular se presentó un severo sangramiento intraoperatorio relacionado con la manipulación ósea y con el tiempo quirúrgico.
Brodsky, Dickinson, Edwin y Rossi 21 demostraron que la mayor intensidad del sangrado en la instrumentación espinal con fusión estuvo relacionada a la duración del tiempo quirúrgico (P= 0.0002) y que este sangrado es mayor luego del daño a hueso y músculos.
La mayoría de las publicaciones 1, 3, 5, 14,19-21 describen que a pesar de la gran variabilidad de las pruebas de la coagulación sanguínea que ocurren durante la cirugía espinal mayor, la frecuencia de aparición de una CID es baja. Investigaciones específicas de trastornos de la coagulación que desencadenen esta enfermedad, durante la cirugía correctora de escoliosis, son escasas; aún en situaciones críticas como las que exponemos a continuación:
Tetzlaff, Yoon y Bell 22 en 1998, informaron un caso de 69 años de edad con diagnóstico de Espondilitis Anquilopoyética, que durante la cirugía correctora presentó un sangrado masivo estimado en 17 litros que requirió de 31 unidades de glóbulos, 18 unidades de plasma fresco, 26 unidades de plaquetas, entre otros sustitutos. Lockwood Bullen y Machin 23 describieron una paciente de 13 años de edad, que presentó sangrado masivo asociado a una prolongación del TP y TPT y un síndrome de Von willebrand adquirido.
Los resultados de nuestro estudio unido al análisis de la literatura revisada, sugieren que los trastornos de la coagulación que ocurren durante la cirugía espinal mayor son muy comunes, sin embargo los pacientes que llegan a desarrollar una CID representan solo un pequeño porcentaje.
Se concluye que la incidencia de aparición de una CID en la cirugía espinal mayor no debe considerarse significativamente elevada. Durante la cirugía espinal mayor las pruebas de coagulación sanguínea variaron en el total de los pacientes. La mayor variabilidad de las pruebas de coagulación sanguínea ocurrió fundamentalmente en el período posterior a la decorticación ósea. El daño hístico constituyó el mecanismo desencadenante de los trastornos de la coagulación. Existió estrecha correlación entre etiología de la escoliosis, tiempo quirúrgico, variabilidad de las pruebas de coagulación sanguínea y volumen total de sangrado.
REFERENCIAS BIBLIOGRÁFICAS
1. Philip J, Mayer M D, Janet A. Coagulopathies associated with major spinal surgery. Clinical orthopedics and related research. 1988; N 245: 83-88.
2. Thomas P, Skulk M D. Global blood management in orthopedic surgery. Clinical orthopedics and related research1998; N 357: 43-49.
3. Jacobs R, Asher M, Gilbert J. Correlation of coagulopathy and pulmonary insufficiency with blood transfusions in spine fusions. Spine 1980; 5(1): 15-19.
4. Raphael BG, Lacker H, Engler G L. Disseminated intravascular coagulation during surgery for scoliosis. Clin orthopedic 1982; 162: 41-46.
5. Siegal T, Seligsohn V, and Aghai E, Modan M: Clinical and laboratory aspects of disseminated intravascular coagulation: A study of 118 cases. Trom Haemost 1978; 39:119-22.
6. Keith H. Bridwell. Surgical treatment for idiopathic adolescent scoliosis. Spine 1999. 2(2):21- 9.
7. Richard H, Gerard J L. Hemodilución. Técnicas. En: Técnicas de ahorro de sangre. 1ra ed. México. 1997.pp. 49- 50
8. Martínez A, Criado A, Pestaña D. Técnicas de reposición hemática en cirugía ortopédica. Mapfhe Medicine 1997; 8 (5): 46- 63.
9. Messmer K. Acute preoperative hemodilution. Physiological basis and clinical application. In Tuma R F, White J V, Messmer K. The role of hemodilution in optimal patient care. Stelzl -Druck Munchen. Germany. 1989. 5 (2): 54-73.
10. Tobias JD. Synthetic factor VIIa to treat dilutional coagulopathy during posterior spinal fusion in two children. Anesthesia 2002; 96 (6): 1522-25
11. Cohn S. Uso de la sangre en el siglo XXI. En; Alternativas al uso de la sangre y derivados. Rev Hosp Clin U de Chile 2000; 11(4): 409-13.
12. Mertz V. Manejo anestésico de la cirugía de escoliosis. Rev. Chil Anest. 2003; 32(2).
13. Aguado BO, Fleites ME. Anestesia para la corrección quirúrgica de una escoliosis severa en una testigo de Jehová. Rev Cub Anest Rean.2003; 2(3): 27-30. En línea. URL disponible en: En línea. Disponible en http://bvs.sld.cu/revistas/scar/vol7_1_08/scar06108.htm
14. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M. Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria and a scoring system for disseminated intravascular coagulation. Thromb Haemostat 2001; 86(5):1327-30.
15. Shapiro, G; Green, W; Fatica, N; Boachie-adjei, O. Medical complications in scoliosis surgery. Current opinion in Pediatrics 2001; 13(1): 33-36.
16. Fengyu Z. Cammisa FP, Sandhu HS, Girardi FP, Khan ZN. Factors Predicting Hospital Stay, Operative Time, Blood Loss, and Transfusion in Patients Undergoing Revision Posterior Lumbar Spine Decompression, Fusion, and Segmental Instrumentation. Spine 2002; 27: 818-24.
17. Hobisch-P; Wirleirtner B, Mair J. Consequences of acute normovolemic haemodilution on haemostasis during major orthopedic surgery. Br J Anaesth 1999; 82(4): 503-9.
18. Krohn CD, Reikeraso O, Brosstodf. Fibrinogen, fibrin and its degradation products in drained blood alter major orthopedic surgery. Int J Artif Organs 2000; 10 (4): 167-71.
19. Kannan S, Meert K, Mooney JF, Hillman W; Carol MS, Warrier I. Bleending of neuromuscular and idiopathic scoliosis patients . Ped Crit Car Med 2006; 3(4): 364-69
20. Fox H J, Thomas CD, Thompson AG. Spine instrumentation for Duchene's muscular dystrophy. J Pediatric Orthop 1997; 17(6): 750-3.
21. Brodsky JW, Dickinson JF, Edwin WD, Rossi CD. Hypotensive Anesthesia for scoliosis surgery in Jehovah's Witnesses. Spine 1991; 16(3): 304-6.
22. Tetzlaff JE, Yoon HJ, Bell G. Massive bleeding during spine surgery in a patient with ankylosing spondylitis. Can J Anaesth 1998; 45(9): 903-6.
23. Lockwood DW, Bullen C, Machin SJ. A severe coagulopathy following volume replacement with hydroxyethyl starch in Jehovahs witness patient. Clin orthopedic 1980; (152): 247: 50.